

我院纳米医学与分子诊疗科研团队在癌症治疗方面取得重要成果
近期,我院纳米医学与分子诊疗科研团队在克服癌症治疗耐受及转移方面取得重要研究成果。
肿瘤治疗耐受及转移是癌症临床治疗失败的主要原因,然而,迄今国内外尚未找到克服肿瘤治疗耐受及抑制转移的有效策略,如何克服肿瘤治疗耐受及抑制转移已成为国内外肿瘤治疗的研究热点。基于纳米技术的新型药物传递体系有望解决上述问题并对肿瘤有效治疗带来新的希望。
肿瘤干细胞(Cancer Stem Cells,CSCs)是肿瘤产生治疗耐受的根源。如何有效地将抗癌药物递送至CSCs,并通过多种治疗模式彻底根除CSCs成为癌症临床治疗中面临的一个重大难题。为解决这一难题,该团队构建出多级靶向及集热化疗联合治疗纳米载药体系。该体系以磁性介孔二氧化硅为药物载体分别通过核靶向递送药物及热化疗联合治疗来增加CSCs对肿瘤药物的敏感性,克服其治疗耐受(如图1和2所示)。该研究成果为靶向CSCs克服治疗耐受提供了全新的思路。该成果先后发表在《Biomaterials》(2019, 200, 1-14)和《Advanced Healthcare Materials》(2019,1900160)上,第一作者分别为我院2014级和2013级硕士研究生李洪娟、刘亚静,刘丹丹副教授与张金超教授为共同通讯作者,河北大学为第一完成单位。
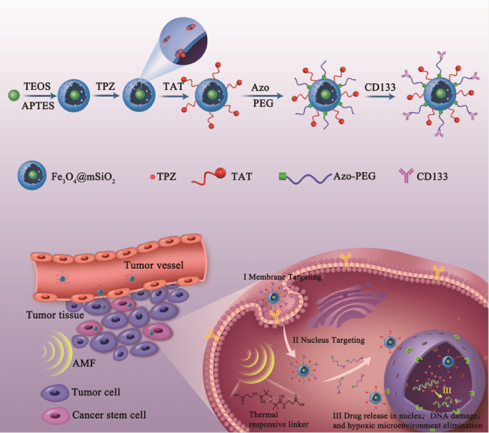
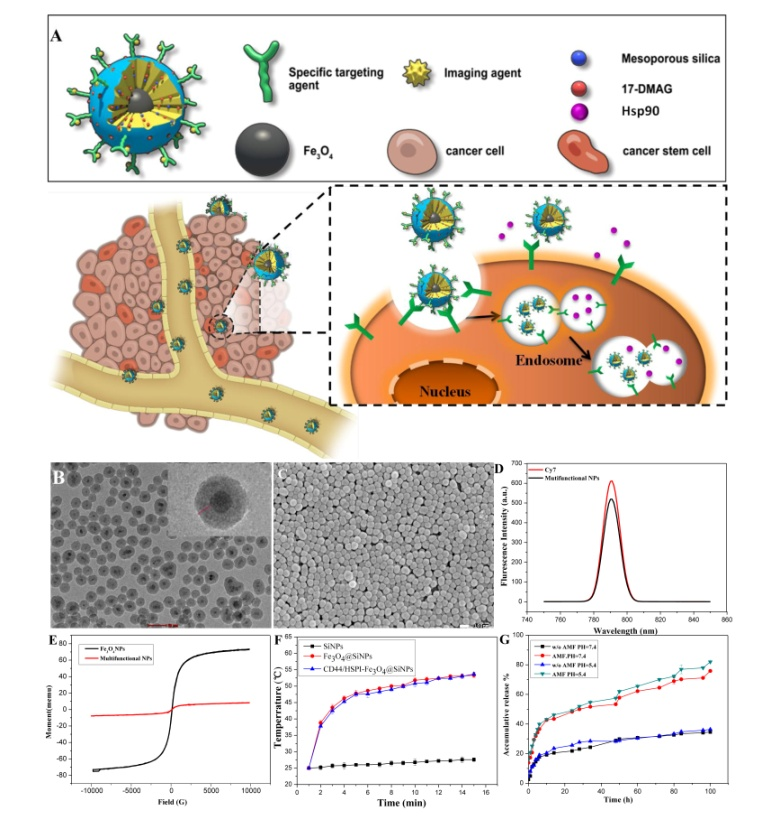
图2. 靶向肿瘤干细胞热化疗联合治疗示意图
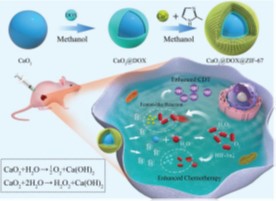
肿瘤生存的乏氧微环境是维持肿瘤细胞干性及产生治疗耐受的重要因素,因此, 缓解肿瘤微环境乏氧、改变肿瘤细胞及肿瘤干细胞生存环境成为克服肿瘤治疗耐受的关键。该团队针对因肿瘤微环境乏氧及过氧化氢浓度不足造成化疗及化学动力学治疗耐受的问题,利用过氧化钙(CaO2)作为O2和H2O2供体,采用自下而上的策略,与化疗药物阿霉素(DOX)和酸敏感金属有机框架材料ZIF-67进行组装,合成了具有化学动力学和化学药物联合治疗功能的纳米治疗试剂CaO2@DOX@ZIF-67。该研究提供了一种能够同时提升肿瘤组织H2O2和O2浓度的新方法,并通过类芬顿反应发挥化学动力学治疗作用,最终实现传统化疗与新型化学动力学联合治疗(图3),从而克服传统肿瘤治疗耐受问题。相关研究成果发表在《Advanced Science》(2019, 1902137)上,我院2017级博士生高书涛为论文的第一作者,李振华副教授、梁兴杰研究员和张金超教授为本文的共同通讯作者,河北大学为第一完成单位。这是自2018年该研究团队针对乏氧肿瘤治疗研究成果(Biomaterials, 2018, 178, 83-94)发表后的又一力作。
骨骼是晚期乳腺癌患者最早且最常见的转移部位之一。目前临床上主要通过化疗药抑制癌细胞活性并抑制其进一步转移,却忽略了骨微环境的复杂性,因此急需找到新型安全靶向的治疗药物。基于此,该团队设计出一种骨靶向的Au@MSNs-ZOL纳米平台,将临床抗骨吸收药物唑来膦酸(ZOL)与光热治疗相结合,通过增强成骨细胞分化并抑制破骨细胞分化,在光热作用下杀死肿瘤细胞,并抑制其进一步侵袭和转移,有效地保护了小鼠骨结构免受肿瘤细胞-成骨细胞-破骨细胞恶性循环的破坏,达到治疗乳腺癌骨转移的目的(图4)。相关研究结果发表在《ACS Nano》(2019, 13, 7, 7556-7567)杂志上。该工作的第一作者为我院2017届硕士研究生孙文通,葛昆副教授和张金超教授为共同通讯作者,河北大学为第一完成单位。 为了进一步了解纳米材料在抑制骨转移过程中对骨微环境及骨代谢的影响,该团队以稀土纳米氧化钇(Y2O3)的生物安全性为切入点,依据稀土纳米材料亲骨性的特点,以原代小鼠骨髓基质细胞为实验模型,研究了纳米Y2O3对骨髓基质细胞的生物效应。证实Y2O3纳米颗粒在溶酶体中经历了从Y2O3降解到YPO4-Y2O3的转换过程,因而破坏了细胞内磷酸盐的平衡,进而引起骨细胞凋亡和骨结构破坏,导致严重的骨损伤(图5)。相关研究结果发表在《ACS Nano》(2019, 13 (1), 313-323)杂志上。该工作的第一作者为我院2014级硕士研究生高春月,靳祎副教授、王书香教授和张金超教授为共同通讯作者,河北大学为第一完成单位。
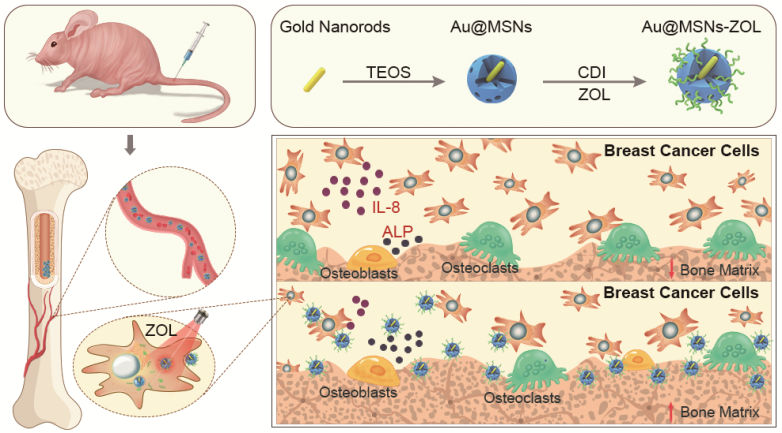
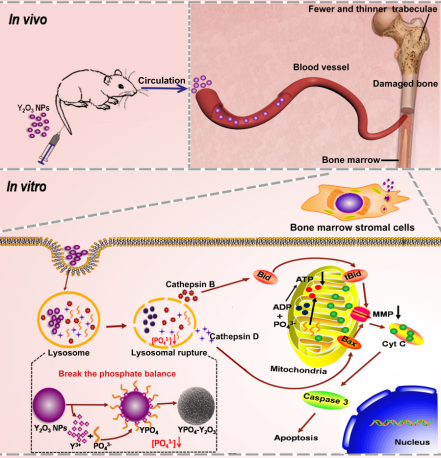
图5. 纳米Y2O3对骨代谢机理示意图
上述研究工作得到了国家自然科学基金、河北省自然科学基金重点项目及河北省自然科学基金的大力资助。
《Advanced Science》是Wiley旗下的国际一流期刊,中科院JCR分区一区刊物,影响因子15.804。《ACS Nano》是美国化学会旗舰刊物、国际材料科学顶级期刊,中科院JCR分区一区刊物,影响因子为13.903。《Biomaterials》是Elsevier旗下国际材料领域顶级期刊,中科院JCR分区一区,影响因子10.273; 《Advanced Healthcare Materials》是Wiley旗下国际著名期刊,中科院JCR分区一区,影响因子6.27。
-
高辉教授学术报告会2024.11.06
-
2024创新药物制剂与临床转化·雄安论坛2024.10.22
-
我院青年教师王刘彬课题组在《Angewandte Chemie International Edition》发表金属有机配...2024.10.18
-
我院张金超课题组在肿瘤纳米催化治疗领域取得重要进展2024.10.15
-
李晨钟教授学术报告会2024.09.30
-
姬晓元教授学术报告会2024.09.23
-
我院高勇军课题组在《Nature Communications》发表废弃碳资源回收利用领域重要进展2024.09.20
-
郭东升教授学术报告会2024.09.04
-
高祥研究员学术报告会2024.05.23
-
关于组织高压化学报告会的通知2024.05.08








